LCHAD/MTP deficiëntie (Long Chain 3-hydroxy-acyl-coenzym A Dehydrogenase Deficiëntie/ Mitochondrial Trifunctional Protein Deficiëntie)
LCHADD of MTPD?
Bij deze ziekte werkt het eiwit Mitochondrial Trifunctional Protein (MTP) niet of niet goed. Dit is een eiwit dat zich bevindt in de mitochondriën en betrokken is bij de afbraak van langeketenvetzuren. ‘Trifunctional’ betekent ‘drievoudige werking’. Dit eiwit bestaat namelijk uit drie verschillende enzymen, die nodig zijn voor de verbranding van langeketenvetzuren. Eén van die enzymen is long chain 3-hydroxy-acyl-coenzym A dehydrogenase (LCHAD). Bij de meeste patiënten werkt dit enzym door een mutatie, een fout in het erfelijk materiaal, niet of minder goed. Dit noemen we LCHAD deficiëntie. Bij andere patiënten werken alle drie de enzymen minder goed. We noemen dit MTP deficiëntie. Ondanks het verschil in enzymen, komen de klachten van patiënten met LCHAD deficiëntie en MTP deficiëntie grotendeels overeen, daarom wordt vaak over LCHAD/ MTP deficiëntie gesproken.
In Nederland komt de ziekte LCHAD/MTP deficiëntie bij 1 op de 300.000 geboren kinderen voor. Dat komt neer op één nieuwe patiënt per jaar. Dit is vaker LCHAD deficiëntie dan MTP deficiëntie. Ook LCHAD en MTP deficiëntie zijn sinds 2007 opgenomen in de hielprikscreening.
De ziekte
De enzymen LCHAD en MTP helpen met het afbreken van de langeketenvetzuren nadat de eerste stap met behulp van het enzym VLCAD is gedaan. Bij patiënten met LCHAD/MTP deficiëntie ontbreekt een van de enzymen of werken ze minder goed. Als langeketenvetzuren niet goed afgebroken kunnen worden, stapelen ze zich op in de cellen. Dit gebeurt vooral in cellen die een grote energiebehoefte hebben, zoals spiercellen en ook hartspiercellen. Deze ophoping van vetzuren is mogelijk slecht voor de cel, al is het precieze effect nog niet goed bekend. Daarnaast kan ook een energietekort voor de cel ontstaan, wanneer alle andere voedingsstoffen zoals suikers, korte en middellangeketenvetzuren, op zijn. In periodes van koorts, lang niet eten of langdurige, zware inspanning, wanneer er een grote energiebehoefte is, kunnen de spiercellen beschadigen en zelfs worden afgebroken. Dit heet rhabdomyolyse. De exacte oorzaak van de rhabdomyolyse is nog niet bekend.
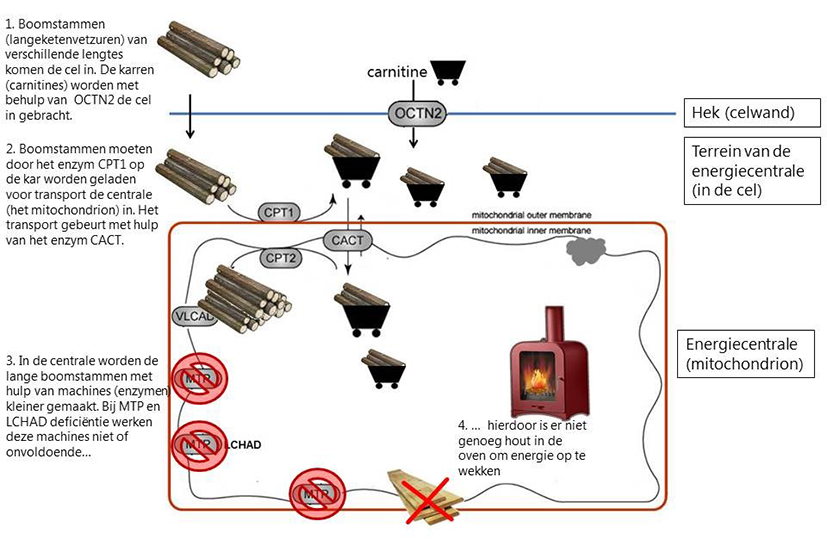
De werking van de enzymen LCHAD en MTP en wat er gebeurt wanneer een van deze enzymen niet of onvoldoende werkt, is goed uit te leggen met het voorbeeld van een hout gestookte energiecentrale, zoals is weergegeven in de onderstaande afbeelding. Boomstammen van verschillende lengtes (de langeketenvetzuren) worden per kar (carnitine) de energiecentrale (het mitochondrion) binnengebracht. Eenmaal in de energiecentrale worden de boomstammen van de kar afgehaald en in kleinere stukken gezaagd om in de verbrandingsoven te passen. De enzymen MTP en LCHAD zagen de laatste stukken van de lange boomstammen af. Wanneer een van deze enzymen niet of onvoldoende werken, kunnen de lange boomstammen niet klein genoeg worden gezaagd. De oven krijgt hierdoor minder brandstof en gaat zachter branden (er ontstaat een energietekort). Er worden nog wel nieuwe boomstammen aangevoerd, waardoor er steeds meer boomstammen en karren met boomstammen op het terrein van de energiecentrale en in de energiecentrale komen te staan (er is stapeling van langeketenvetzuren in de cel).
klachten / symptomen
Wat een groot verschil is met andere langeketenvetzuuroxidatiestoornissen zoals VLCAD deficiëntie is dat bij LCHAD en MTP deficiëntie ook cellen van het netvlies van het oog en de zenuwcellen kunnen beschadigen. Door problemen van het netvlies, kunnen patiënten geleidelijk slechter gaan zien en kunnen uiteindelijk blind worden. De beschadiging van de zenuwen leidt vaak tot slechtere aansturing van spieren in de onderarmen en –benen, waardoor spieren zwakker worden en ook het gevoel in de huid kan verminderen. Hoe dit komt en waarom dit alleen bij deze langeketenvetzuuroxidatiestoornissen voorkomt, is nog niet geheel duidelijk.
Sommige patiënten hebben last van epilepsie, concentratiestoornissen en/ of leerproblemen. Dit wordt niet direct door de problemen in de vetzuurverbranding veroorzaakt, maar is vaak het gevolg van zeer lage bloedsuikers (hypoglykemieën) tijdens een ontregelde periode, vaak in het eerste levensjaar. Hersencellen zijn erg gevoelig voor energietekort dat wordt veroorzaakt door de te lage bloedsuikers en kunnen daardoor schade oplopen.
Diagnose
Tijdens de hielprikscreening wordt er gekeken naar de acylcarnitines in het bloed. Acylcarnitines zijn vetzuren die gekoppeld zijn aan carnitine. Als de waardes afwijkend zijn en passen bij een mogelijke LCHAD of MTP deficiëntie, zal de baby worden doorverwezen naar een kinderarts die gespecialiseerd is in stofwisselingsziekten om verder onderzoek te doen of er daadwerkelijk sprake is van LCHAD of MTP deficiëntie. Het is bijna altijd mogelijk om binnen een aantal weken met zekerheid vast te stellen of uit te sluiten of een kind een (langeketen) vetzuuroxidatiestoornis heeft.
De diagnose LCHAD of MTP deficiëntie kan worden gesteld door de werking van de verschillende enzymen van mitochondrial trifunctional protein (MTP) te meten in de cellen van de patiënt. Ook de werking van het enzym long chain 3-hydroxy-acyl-coenzym A dehydrogenase (LCHAD)) wordt dan gemeten. De werking van de enzymen kan worden gemeten in de witte bloedcellen en in gekweekte huidcellen van de patiënt, waarvoor een stukje huid wordt afgenomen (biopt). Ook wordt onderzocht of er een mutatie, een fout in het erfelijk materiaal, aanwezig is, die LCHAD of MTP deficiëntie kan veroorzaken.
In het erfelijk materiaal van de ouders kan worden onderzocht of zij drager zijn van de mutatie die bij hun kind de ziekte heeft veroorzaakt. Als er meer kinderen in het gezin zijn, worden zij meestal ook onderzocht.
Behandeling en zorg
De mate van klachten en hoe snel de klachten verergeren is per patiënt verschillend en wordt mogelijk vertraagd door voorzorgsmaatregelen en/of een aangepast dieet. Vooral op jonge leeftijd kunnen de klachten zeer ernstig zijn en is er een grotere kans op overlijden. Als de ziekte pas op latere leeftijd klachten geeft, bereiken de meeste patiënten met (dieet)aanpassingen de volwassen leeftijd. Een aangepast dieet kan bestaan uit een beperking van langeketenvetzuren in de voeding en een toevoeging van middellangeketenvetzuren.
Daarbij is het voor iedereen met een vetzuuroxidatiestoornis belangrijk dat ze niet te lang niets eten of drinken. Er wordt daarom vaak een ‘maximale vastentijd’ afgesproken met de arts. Dit is de maximale tijd dat er tussen twee maaltijden mag zitten. In plaats van een tussendoortje of maaltijd, kan er ook een koolhydraatrijke drank worden genuttigd. De maximale vastentijd wordt in periodes van ziekte, wanneer het lichaam veel energie nodig heeft, minstens gehalveerd. Dit betekent dat je twee keer zo vaak of vaker iets moet eten of drinken. Daarbij kan eventueel gebruik worden gemaakt van extra inname van koolhydraten in de vorm van dextrine maltose (Fantomalt).


